Germanio
Recopilación bibliográfíca: Dra. Rosalía Villoldo Pérez
Germanio esta muy cerca del silicea:

Los elementos químicos de la familia del Carbono, que agrupa además del citado al Silicio, Germanio, Estaño y Plomo, poseen unas estructuras atómicas que los convierten en potentes comodines combinacionales. A medida que su peso atómico es creciente, su estado de agregación varía desde el gaseoso para el Carbono hasta el metálico del resto, aunque Silicio y Germanio suelen considerarse semimetales.
Características principales:
Es un metaloide sólido duro, cristalino, de color blanco grisáceo lustroso, deleznable, que conserva el brillo a temperaturas ordinarias. Presenta la misma estructura cristalina que el diamante y resiste a los ácidos y álcalis.
Forma gran número de compuestos órgano-metálicos y es un importante material semiconductor utilizado en transistores y fotodetectores. A diferencia de la mayoría de semiconductores, el germanio tiene una pequeña banda prohibida (band gap) por lo que responde de forma eficaz a la radiación infrarroja y puede usarse en amplificadores de baja intensidad.
|
General |
|||||||||||||||||||||||||||||||
|
Nombre, símbolo, número |
Germanio, Ge, 32 |
||||||||||||||||||||||||||||||
|
Serie química |
|||||||||||||||||||||||||||||||
|
Grupo, periodo, bloque |
|||||||||||||||||||||||||||||||
|
Densidad, dureza Mohs |
5323 kg/m3, 6 |
||||||||||||||||||||||||||||||
|
Propiedades atómicas |
|||||||||||||||||||||||||||||||
|
72,64 u |
|||||||||||||||||||||||||||||||
|
Radio medio† |
125 pm |
||||||||||||||||||||||||||||||
|
125 pm |
|||||||||||||||||||||||||||||||
|
122 pm |
|||||||||||||||||||||||||||||||
|
Sin datos |
|||||||||||||||||||||||||||||||
|
4 (anfótero) |
|||||||||||||||||||||||||||||||
|
Cúbica centrada en las caras |
|||||||||||||||||||||||||||||||
|
Propiedades físicas |
|||||||||||||||||||||||||||||||
|
Sólido |
|||||||||||||||||||||||||||||||
|
1211,4 K |
|||||||||||||||||||||||||||||||
|
3093 K |
|||||||||||||||||||||||||||||||
|
330,9 kJ/mol |
|||||||||||||||||||||||||||||||
|
36,94 kJ/mol |
|||||||||||||||||||||||||||||||
|
0,0000746 Pa a 1210 K |
|||||||||||||||||||||||||||||||
|
5400 m/s a 293,15 K |
|||||||||||||||||||||||||||||||
|
Información diversa |
|||||||||||||||||||||||||||||||
|
2,01 (Pauling) |
|||||||||||||||||||||||||||||||
|
320 J/(kg·K) |
|||||||||||||||||||||||||||||||
|
1,45 m-1·Ω-1 |
|||||||||||||||||||||||||||||||
|
59,9 W/(m·K) |
|||||||||||||||||||||||||||||||
|
762 kJ/mol |
|||||||||||||||||||||||||||||||
|
2° potencial de ionización |
1537,5 kJ/mol |
||||||||||||||||||||||||||||||
|
3° potencial de ionización |
3302,1 kJ/mol |
||||||||||||||||||||||||||||||
|
4° potencial de ionización |
4411 kJ/mol |
||||||||||||||||||||||||||||||
|
5° potencial de ionización |
9020 kJ/mol |
||||||||||||||||||||||||||||||
|
Isótopos más estables |
|||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||
|
Valores en el SI y en condiciones normales |
|||||||||||||||||||||||||||||||
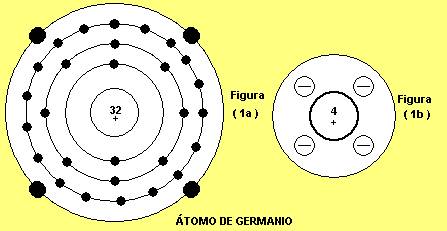
El germanio es un elemento químico con número atómico 32, y símbolo Ge
|
|
xisten gran cantidad de minerales que poseen propiedades de conducción de la electricidad, como el oro (conductores), otros muchos que se oponen a la corriente eléctrica en mayor o menor medida, como la mica (aislantes), y unos pocos de un tipo intermedio que, según el punto de vista, conducen la electricidad medianamente o son poco aislantes, como el germanio o el silicio (semiconductores).
Gracias a minerales con alto contenido en germanio o silicio, se han desarrollado semiconductores que permitieron al ser humano conseguir en muy poco tiempo un nivel tecnológico sin precedentes, si se compara con el progreso adquirido a lo largo de su historia; de hecho estamos rodeados de semiconductores, y existen pocos circuitos electrónicos que no incorporen en alguna medida un componente a base de ellos, como los transistores (conjunto de la unión de diodos semiconductores) sin los cuales no se concebirían, por ejemplo, los potentes ordenadores de hoy en día.

Minerales con alto contenido en germanio, como la germanita, ha permitido desarrollar semiconductores que permitieron al ser humano conseguir un nivel tecnológico sin precedentes
Otras propiedades de algunos minerales es la capacidad de generar energía eléctrica por medio de presión (piezoelectricidad), calor (piroelectricidad), o cortando líneas de fuerza (magnetismo); los minerales que poseen magnetismo pueden también atraer otros minerales de hierro o derivados de él.
Propiedades químicas del Germanio - Efectos del hidruro de Germanio y el tetrahidruro de Germanio sobre la salud - Efectos ambientales del Germanio
Nombre: Germanio
Número atómico: 32
Valencia : 4
Estado de oxidación: +4
Electronegatividad : 1,8
Radio covalente (Å): 1,22
Radio iónico (Å): 0,53
Radio atómico (Å) : 1,37
Configuración electrónica : [Ar]3d104s24p2
Primer potencial de ionización (eV): 8,16
Masa atómica (g/mol) : 72,59
Densidad (g/ml) : 5,32
Punto de ebullición (ºC) : 2830
Punto de fusión (ºC): 937,4
Descubridor : Clemens Winkler 1886
Germanio

Elemento químico, metálico, gris plata, quebradizo, símbolo Ge, número atómico 32, peso atómico 72.59, punto de fusión 937.4ºC (1719ºF) y punto de ebullición 2830ºC (5130ºF), con propiedades entre el silicio y estaño.
El germanio se encuentra muy distribuido en la corteza terrestre con una abundancia de 6.7 partes por millon (ppm). El germanio se halla como sulfuro o está asociado a los sulfuros minerales de otros elementos, en particular con los del cobre, zinc, plomo, estaño y antimonio.
El germanio tiene una apariencia metálica, pero exhibe las propiedades físicas y químicas de un metal sólo en condiciones especiales, dado que está localizado en la tabla periódica en donde ocurre la transición de metales a no metales. A temperatura ambiente hay poca indicación de flujo plástico y, en consecuencia, se comporta como un material quebradizo.
El germanio es divalente o tetravalente. Los compuestos divalentes (óxido, sulfuro y los halogenuros) se oxidan o reducen con facilidad. Los compuestos tetravalentes son más estables. Los compuestos órgano-germánicos son numerosos y, en este aspecto, el germanio se parece al silicio. El interés en los compuestos órgano-germánicos se centra en su acción biológica. El germanio y sus derivados parecen tener una toxicidad menor en los mamíferos que los compuestos de estaño o plomo.
Las propiedades del germanio son tales que este elemento tiene varias aplicaciones importantes, especialmente en la industria de los semiconductores.
El primer dispositivo de estado sólido, el transistor, fue hecho de germanio. Los cristales especiales de germanio se usan como sustrato para el crecimiento en fase vapor de películas finas de GaAs y GaAsP en algunos diodos emisores de luz.
Se emplean lentes y filtros de germanio en aparatos que operan en la región infrarroja del espectro. Mercurio y cobre impregnados de germanio son utilizados en detectores infrarrojos; los granates sintéticos con propiedades magnéticas pueden tener aplicaciones en los dispositivos de microondas para alto poder y memoria de burbuja magnética; los aditivos de germanio incrementa los amper-horas disponibles en acumuladores.
Efectos del hidruro de Germanio y el tetrahidruro de germanio sobre la salud
El hidruro de germanio y el tetrahidruro de germanio son extremadamente inflamables e incluso explosivos cuando son mezclados con el aire.
Inhalación por accidente de este mineral dan:
Calambres abdominales.
Sensación de quemadura.
Tos.
Piel: Enrojecimiento.
Dolor.
Ojos: Enrojecimiento. Dolor.
Peligros físicos: El gas es más pesado que el aire y puede viajar por el suelo; es posible la ignición a distancia.
Vías de exposición: La sustancia puede ser absorbida por el cuerpo por inhalación.
Riesgo de inhalación: En caso de pérdidas en el contenedor se alcanzará rápidamente una concentración peligrosa del gas en el aire.
Efectos de la exposición a corto plazo: La sustancia irrita los ojos, la piel y el tracto respiratorio. La sustancia puede tener efectos en la sangre, resultando en lesiones de las células sanguíneas. La exposición puede resultar en la muerte.
Efectos ambientales del Germanio: Como metal pesado se considera que tiene algún efecto negativo en los ecosistemas acuáticos.
Aplicaciones en la vida cotidiana:
Las aplicaciones del germanio se ven limitadas por su elevado costo y en muchos casos se investiga su sustitución por materiales más económicos.
- Fibra óptica.
- Electrónica: radares y amplificadores de guitarras eléctricas usados por músicos nostálgicos del sonido de la primera época del rock and roll; aleaciones SiGe en circuitos integrados de alta velocidad. También se utilizan compuestos sandwich Si/Ge para aumentar la movilidad de los electrones en el silicio (streched silicon)
- Óptica de infrarrojos: Espectroscopios, sistemas de visión nocturna y otros equipos.
- Lentes, con alto índice de refracción, de ángulo ancho y para microscopios.
- En joyería se usa la aleación Au con 12% de germanio.
- Como elemento endurecedor del aluminio, magnesio y estaño.
- Quimioterapia.
- El teratracloruro de germanio es un ácido de Lewis y se usa como catalizador en la síntesis de polímeros (PET).
Ejemplos:
Orgullosos de los avances en la prevención de accidentes el ICAR ha desarrollado
sistemas infrarrojos para aplicaciones de alto volumen y bajo costo está ahora en curso gracias al desarrollo de nuevas tecnologías: matriz de plano focal infrarrojo no enfriado y vidrio infrarrojo.

Figura: ICAR - HMI en el Panel de Control y HMI - Protótipo en la dirección.
Estos sistemas fueron desarrollados después de tres años, de actividad intensa en el de proyecto, en particular los resultados obtenidos con detectores y elementos ópticos fabricados para el proyecto ICAR. El objetivo de este proyecto es percibir un peatón a
una distancia de por lo menos 190 m y vehículos a aproximadamente 500 m para poder evitarlos si fuera necesario.
Las lentes infrarrojas son hechas de lingotes monocristalinos de germanio o selenito de Zinc cortadas en bloques y pulidas para la obtención de lentes infrarrojas.
Ese método es lento y caro y está en desarrollo un nuevo enfoque para la fabricación de lentes infrarrojas a partir de vidrio infrarrojo. Este tipo de material podría ser moldeado directamente en el formato final de la lente, disminuyendo el costo de fabricación resultante al mismo tiempo que mantiene un alto nivel de rendimiento usando lentes Fresnel o lentes esféricas.Umicore IR Glass S.A. es una empresa especializada en la producción de componentes ópticos y vidrios de calcogenuro por moldeado. La Umicore IR Glass desarrollo una nueva composición de vidrio de calcogenuro.
 Lente de Germanio.
Lente de Germanio.
Con lo cual podemos observar que el Germanio esta muy ligado a lo que se ve a través de él.
Historia:
Las propiedades del germanio (del latín Germania, Alemania) fueron predichas en 1871 por Mendeleyev en función de su posición en la tabla periódica, elemento al que llamó eka-silicio. El alemán Clemens Winkler demostró en 1886 la existencia de este elemento, descubrimiento que sirvió para confirmar la validez de la tabla periódica habida, cuenta con las similitudes entre las propiedades predichas y las observadas:
Obtención:
Los únicos minerales rentables para la extracción del germanio son la germanita (69% de Ge) y ranierita (7-8% de Ge); además está presente en el carbón, la argirodita y otros minerales. La mayor cantidad, en forma de óxido (GeO2), se obtiene como subproducto de la obtención del cinc o de procesos de combustión de carbón (en Rusia y China se encuentra el proceso en desarrollo).
La purificación del germanio pasa por su tetracloruro que puede ser destilado y luego es reducido al elemento con hidrógeno o con magnesio elemental.
Con pureza del 99,99%, para usos electrónicos se obtiene por refino mediante fusión por zonas resultando cristales de 25 a 35 mm usados en transistores y diodos; con esta técnica las impurezas se pueden reducir hasta 0,0001 ppm.
El desarrollo de los transistores de germanio abrió la puerta a numerosas aplicaciones electrónicas que hoy son cotidianas. Entre 1950 y a principios de los 70, la electrónica constituyó el grueso de la creciente demanda de germanio hasta que empezó a sustituirse por el silicio por sus superiores propiedades eléctricas. Actualmente la gran parte del consumo se destina a fibra óptica (cerca de la mitad), equipos de visión nocturna y catálisis en la polimerización de plásticos, aunque se investiga su sustitución por catalizadores más económicos. En el futuro es posible que se extiendan las aplicaciones electrónicas de las aleaciones silicio-germanio en sustitución del arseniuro de galio especialmente en las telecomunicaciones sin cable.
Además se investigan sus propiedades bactericidas ya que su toxicidad para los mamíferos es escasa.
El germanio tiene cinco isótopos estables siendo el más abundante el Ge-74 (35,94%). Se han caracterizado 18 radioisótopos de germanio, siendo el Ge-68 el de mayor vida media con 270,8 días. Se conocen además 9 estados meta-estables.
Algunos compuestos de germanio (tetrahidruro de germanio) tienen una cierta toxicidad en los mamíferos pero son letales para algunas bacterias. Tambien es letal para la taenia.
El germanio se encuentra más comúnmente en la naturaleza como un contaminante de diversos minerales y es obtenido de los residuos de cadmio remanentes del procesado de los minerales de zinc. Las investigaciones toxicológicas han demostrado que el germanio no se localiza en ningún tejido dado que se excreta rápidamente principalmente por la orina. Las dosis excesivas de germanio lesionan los lechos capilares de los pulmones. Produce una diarrea muy marcada que provoca una deshidratación, hemoconcentración, caída de la presión arterial e hipotermia.
Investigaciones con Germanio:
Es notable como investigadores de los Estados Unidos precisamente los Dr. Kazuhiko Asai Niwa de Nueva York- Atlanta y el Dr. Anon Vantage Press de Los Ángeles / Chicago han trabajo en pacientes con CÁNCER y AIDS, con GERMANIO, logrando ciertos resultados alentadores.
El Dr. José Ramón Llorente, Presidente de la "Sociedad Española de Nutrición Ortomolecular", nos cuenta que fue en 1967 cuando el Dr. Kazuhiko Asai consiguió sintetizar el Ge-132, una forma de germanio ligado orgánicamente y no tóxico.
En su forma orgánica, cada átomo de germanio está ligado a tres átomos de oxígeno convirtiéndose en un excelente transportador de oxígeno.
El Dr. Otto Warburg -investigador del cáncer y premio Nobel- descubrió por su parte que las células cancerosas no pueden metabolizar adecuadamente el oxígeno.
El germanio 132 actúa como transportador facilitando el movimiento del oxígeno a través de las membranas celulares a fin de introducir oxígeno en la célula. Refuerza además muchas funciones del sistema inmunitario. Varios estudios han informado de la capacidad del Ge-132, administrado por vía oral, para aumentar la actividad de las células asesinas naturales.
Además, un estudio publicado en el “Journal of Interferon Research" concluía que
"el germanio orgánico restaura el funcionamiento normal de células-T y linfocitos-B; el germanio orgánico tiene actividades fisiológicas excepcionales siendo capaz de estimular la producción de gamma-interferón, tanto en animales como en seres humanos, sin efectos laterales ni toxicidad".
Su absorción se realiza en el intestino delgado, aproximadamente un 30% del total ingerido.
Su nivel máximo en sangre se presente aproximadamente a las tres horas de haber sido ingerido, desapareciendo entre las 48 y 72 horas posteriores eliminado por la orina.
Es un elemento que no se almacena en el organismo por lo que no es tóxico siempre que hablemos de su forma orgánica; no sucede lo mismo con otros compuestos inorgánicos.
Las mejores fuentes de este mineral las podemos hallar en el ajo, el aloe vera, el ginseng, los champiñones y la borraja.
FUNCIONES QUE DESEMPEÑA
- Protege de los radicales libres.
- Favorece la producción de anticuerpos.
- Incrementa la eficacia en el transporte de oxígeno.
- Permite el buen funcionamiento de los linfocitos T y B.
SU DEFICIENCIA PUEDE PROVOCAR
- Falta de oxigenación cerebral.
- Alteraciones del sistema inmunitario.
- Disminución en el contenido de oxígeno de los órganos.
- Mayor tendencia a las infecciones causadas por virus.
- Acumulación de radicales libres.
CAUSAS QUE FAVORECEN SU DÉFICIT
- Dietas pobres en vegetales frescos.
A TENER EN CUENTA
- Deben tomar precauciones aquellas personas que tengan tendencia a la hipoglucemia.
TOXICIDAD
La única forma de germanio que no posee contraindicaciones es el Germanio-132. Aunque, como siempre, su uso terapéutico debe ser siempre supervisado por un profesional de la salud.
NUTRIENTES SINÉRGICOS
- Vitamina A.
- Vitamina B-15.
- Vitamina C.
- Vitamina E.
- Selenio.
- Cinc.
- Coenzima Q-10.
Germanium es un nuevo remedio Homeopático.
J. Sherr ha hecho una patogenesia en 1995. El nombre se debe a que este elemento
se ha descrito en Alemania por el alemán Clemens Winkler en 1886.
Los síntomas más importantes de su informe son:
En cuanto a los conceptos básicos se encuentra:
Vacío
Débil
Eliminando
Desviado de sus objetivos
Dejado de lado
Irresponsable
Indiferente
Tiene siempre una forma distante
Se siente como cubierto, prisionero, atrapado.
Es como que tiene una “Máscara vacía” sin identidad.
Siente :
El Deber
El Trabajo
Las Tarea
Usa la Destreza
Busca la Perfección y desarrolla las habilidades
Sigue las Reglas, el orden y la rutina.
Se siente siempre como que le estan tomando examen y debe tener todo bajo control
Como si fuera observado - Crítica
Como si cometiera un Crimen, siente culpa, y se siente fracasado, perseguido, probado
En la sociedad se comporta:
En una profesión formal: funcionario público.
Manteniendo el orden para el show.
Rutinas formales: formalidades.
Manteniendo una máscara de perfección.
Escapando a la responsabilidad: extraños.
Haciendo a un lado las acusaciones.
Fracaso a través del comportamiento irresponsable.
Desempeños rutinarios.
Imagen de Germanium Metallicum:
Esencia: siempre elige una profesión formal, es un funcionario, oficial, que inspira respeto, por que imparte el orden pero no toman responsabilidades reales. Ellos llevan a cabo su tarea pro forma. Tienen miedo de ser encontrados responsables de cualquiera de sus acciones. Mantienen el orden como una formalidad pero realmente no están interesados en lo que están haciendo. Como un maestro que perdió interés hace tiempo, que sólo se preocupa por mantener el orden, para sostener su trabajo y poder ganarse la vida (Sherr, 95). Están en “automático”, hablando sólo con clichés y lugares comunes.
Rutinas formales: toman las formalidades
Aman esconderse detrás de las formalidades.
En tanto trabajen con muchas formas oficiales, podrán estar seguros que no serán personalmente responsables por nada.
A menudo retienen información, escondiéndose bajo una máscara de perfeccionismo (Sherr).
Pero se sienten restringidos al mismo tiempo, un prisionero de movimiento controlado y discurso moderado. Diplomáticos, espías, guardaespaldas.
Temen haber cometido un error después de todo el esfuerzo que les costo mantener la rectitud en su accionar, se asustan de autoridades, policía, padres, maestros o directores, mirándolos y encontrando que han hecho algo mal.
Escapando a la responsabilidad: extraños.
Intentan toda clase de maniobras para evitar ser tomados como responsables de algún hecho.
Delegan responsabilidades en otras personas, le escabullen a las acusaciones, niegan sus errores o dicen que fue culpa de otros, etc (Sherr 95).
Se sienten incomprendidos e inútiles comparados con sus colegas.
Para distraer la atención de sus propios errores, culparán a otros.
Se convierten en extraños, apartados de sus colegas y de su entorno.
Eventualmente se sentirán alejados de sí mismos, como si hubieran dejado su cuerpo.
Fracaso por comportamiento irresponsable.
Porque niegan su responsabilidad hay ciertas cosas que están condenadas a salirles mal.
La apariencia externa todavía puede estar allí, pero es sólo una cáscara vacía.
Son impotentes para llevar a cabo su tarea, pero hacen de cuenta que todo está bien y siguiendo su curso normal (Sherr).
Pero su vida se ha atascado y no hay nada que ellos pueden hacer.
El declive es innegable y sienten que todos sus esfuerzos han sido en vano. Ya están demasiado cansados para hacer algo.
Manifestaciones:
Miedos: fracaso, caída, parálisis, crítica, responsabilidades, autoridad, policía, ser desenmascarado, oposición, observado, anticipación, violencia.
Sueños: esfuerzos fútiles, perder el autobús, olvidarse su equipaje, de tener parálisis, guerra, violencia, víctimas, ventanas rotas o espejos, ser perseguido, amenazado, accidentes, ladrones, cerraduras rotas, policía, erótico, ser violado, agua, fuego, la familia, el hermano, la hermana.
Ilusiones: errores, culpa, crimen, cobarde, prohibido, prisionero, el mundo está gastado, extraño, aislado, todo parece más pequeño o más bajo, el tiempo pasa despacio, oye voces dobles, las manos no pertenecen a él, caos.
Humor: débil, embotado, vacío, llano, indiferente, irreal, ningún romanticismo, desesperado, desvalido, sombrío, condenado, inquieto.
Irritabilidad: contenida; agrava tener que contestar, ser abusado.
Mental: preciso, distraído, vacío, lento, desconcertado, olvidadizo, se equivoca hablando y escribiendo, dislexia.
Colores: marrón y verde.
Causalidad: insultos, ser interrumpido.
Generales
Temperatura: friolento, agrava frío, agrava llovizna.
Horario: agrava 5 a.m.
Deseos: bebidas.
Sueño: bosteza.
Físico: agrava metales pesados.
Afecciones
Cáncer. Malaria.
Parálisis, caminando hacia atrás, piernas temblando. Ataxia, cerebelo.
Dificultad hablando. Entumecimiento. Desmielinización de los nervios.
Cefaleas
Dolores de garganta, mucha mucosidad.
Pulmonía, bronquitis, lesiones de hígado y riñón, hemólisis (Dreisbach).
Alta tensión arterial. Palpitaciones. Anemia (3).
Afecciones del Estómago. Diabetes.
Fallas renales.
Inflamación de articulaciones. Amiloidosis.
Metabolismo afectado por Germanium: cisteína, radicales libres.
Dra. Rosalía Villoldo Pérez
Médica Máster en Homeopatía - Pediatra – Medicina Familiar
Directora Médica de Campos de Salud®,
Directora de la Universidad de Homeopatía (e-learning)
Presidenta del 5to Congreso Virtual de Homeopatía del Cono Sur para el Mundo,
Fundadora de la 1ra Base de Datos Homeopáticos en Español.
Bibliografía:
- Naturaleza Educativa: Portal de Ciencias Naturales y aplicadas:
http://www.natureduca.com/geol_mineral_propied6.php
- Revista de quimica.
http://www.lenntech.com/espanol/tabla-peiodica/Ge.htm
- Actualidades de la Nano Ciencia y Micro Tecnologia para la Indústria y la Academia Manaus, 15/04/2008 - Año III - N.º 11 - Diciembre/2007 - Ministerio de Desenvolvimiento, industria y comercio exterior.
http://www.suframa.gov.br/minapim/news/visArtigo.cfm?Ident=119&Lang=ES
- Una cura natural para el cáncer germanio - Como Vencer las Enfermedades Virales desde la A (AIDS) Por el Dr. Kazuhiko Asai Niwa y el Dr. Anon Vantage Press/ Nueva York- Atlanta Los Ángeles / Chicago – USA.
http://www.nutriologiaortomolecular.org/com/GE/search.htm
- Enciclopedia libre
http://enciclopedia.us.es/index.php/Germanio
- USGS - Estadísticas sobre el germanio (producción, consumo y precios)
http://minerals.usgs.gov/minerals/pubs/commodity/germanium/
- Revista Discovery DSalud
http://www.dsalud.com/medicinaorto_numero30_%20b.htm
- SCHOLTEN Jan, Homeopatía y los Elementos - 1995